"Vers de terre absents, sol calcaire : ce que révèle le pH de votre potager"
- Bertrand Jean-Mairet

- 30 juin 2025
- 5 min de lecture
Une cliente me demande quelques conseils pour son potager. Il s’agit d’un joli jardin entouré de murs de soutènement, bien orienté et bien ensoleillé. Lors de la visite du jardin, ma cliente m’indique qu’il y a une très faible population de vers de terre malgré des apports en matière organique réguliers, un sol très souple et une terre qui paraît fertile.

Après avoir procédé à une observation du site et des plantes existantes, je prélève des échantillons de sol pour les analyser avec la mesure du pH notamment. A ma grande surprise, les valeurs mesurées se situent entre pH 7,5 et pH 8,0. Dans notre vallée, nous sommes habitués aux terrains plutôt acides. Me suis-je trompé ? Apparemment non, mon appareil est correctement calibré et plutôt précis.

En observant les plantes présentes naturellement sur le jardin, je constate la présence marquée de Chélidoine ou Herbe-aux-verrues dont la particularité est qu’elle se plaît dans les milieux calcaires. Si nous sommes proches d’une roche calcaire, et il n’y a que ça dans toute la chaîne du Jura, une influence de cette dernière sur le pH semble envisageable.
En donnant le retour de mes observations et analyses à ma cliente, je lui conseille de couvrir le sol à l’automne avec du bois déchiqueté de résineux ou d’écorce qui auront comme effet de réduire le pH de son sol, de l’acidifier quelque peu pour revenir dans une plage de pH 6,5 à pH 7,5.
Là-dessus, ma cliente me raconte que, lorsqu’elle avait repris le jardin, son ancien propriétaire lui avait dit qu’à chaque automne, il mettait des branches de sapins avec les aiguilles pour couvrir le jardin. Il avait ajouté que s’il ne le faisait pas, ça ne poussait plus mais sans expliquer le fondement de cette pratique. Aussi, n’en comprenant pas vraiment le sens, ma cliente n’avait pas suivi cette pratique. J’en aurais fait de même.
Je venais d’avoir la confirmation de ce que j’espérais avoir déterminé. En effet, les aiguilles acidifient le sol et se décomposent rapidement. L’ancien propriétaire savait ce qu’il fallait faire pour maintenir un pH dans une plage favorisant la vie du sol et l’absorption des nutriments par les plantes. La tendance de ce jardin était d'avoir un pH naturellement élevé (pH 8,0) ce qui pouvait expliquer le pourquoi d'une faible population de vers de terre avec certainement une faible activité biologique ne favorisant pas la fertilité de la terre.
Aussi, une analyse du sol, et notamment du pH, peut s’avérer très utile même pour un potager ! Merci Dominique pour cette chouette opportunité.
Pour en savoir plus sur le pH...
Pour que les plantes puissent se développer, elles doivent pouvoir absorber les nutriments contenus dans le sol. En agriculture, les trois nutriments les plus connus sont l’azote (N), le phosphore (P) et le potassium (K). C’est le trio NPK.
Prenons l’exemple de l’azote (N). Ce dernier, à l’état naturel, est diatomique comme l’oxygène. Il s’agit donc d’une molécule de deux atomes désignée N2. En l’état, c’est un gaz incolore et inodore qui constitue 78 % de l’air que nous respirons. Pour que l’azote puisse être stocké dans le sol, il doit avoir une autre forme. On parle de nitrite (NO2-) ou de nitrate (NO3-), essentielle à la croissance des plantes. Ces deux composés sont présents naturellement dans le sol mais sont aussi la base des engrais azotés utilisés dans l’agriculture.
Or, pour que l’azote, sous sa forme nitrate, puisse être absorbée par les plantes, il faut un pH se trouvant dans une fourchette allant de pH 6,0 à pH 7,0, ce que montre le diagramme ci-dessous. En dehors de cette plage, l’absorption devient plus difficile pour plusieurs minéraux avec un impact important sur la croissance des plantes.
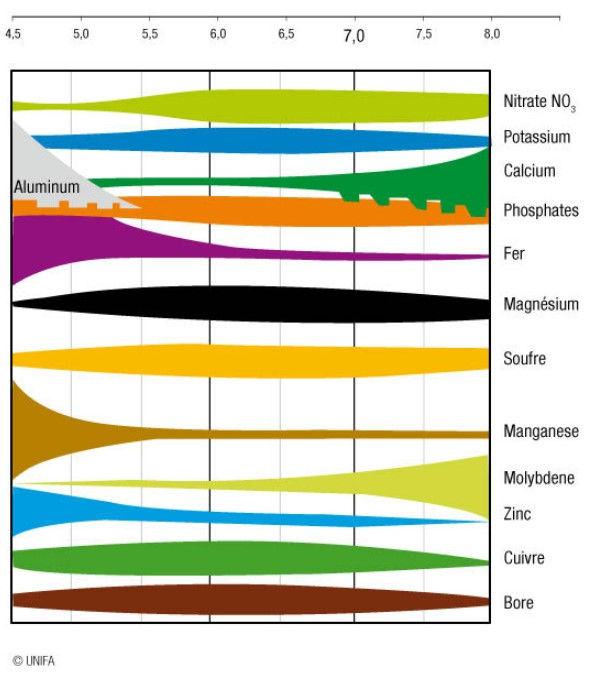
Si un sol de vient trop acide, pH < 5,5, l’aluminium devient alors soluble et peut être absorbé par les plantes. Or, ce dernier est toxique. Il faut donc éviter d’avoir des sols trop acides pour la culture.
Le pH impacte également la vie du sol. C’est notamment le cas pour les vers de terre qui se développent bien dans une plage allant de pH 6,5 à pH 7,5. Au-dessus et au-dessous, la population de vers de terre risque de se réduire fortement et avec elle, l'activité biologique du sol favorable à la fertilité. Exemple extrême, dans la tourbe ayant un pH < 5,0, on ne trouve pas de ver de terre.
Pour les vers de terre, il faut également ajouter que l'humidité dans la terre joue un rôle capital pour leur développement et leur survie. Aussi, l'arrosage ne doit pas être négligé même si le pH est équilibré.
Définition du pH
Le pH, pour Potentiel Hydrogène, a été introduit en 1909 par le chimiste danois Søren Peter Lauritz Sørensen au laboratoire Carlsberg. Ceci permettait de quantifier la concentration d’ions d’hydrogène (H+) dans une solution et de déterminer ainsi son acidité ou son alcalinité.

Le pH n’a pas d’unité proprement dite comme une longueur que l’on peut exprimer en mètres par exemple. La valeur de pH 7,0 correspond à l’eau dite neutre. C’est autour de cette valeur que ce situent le pH du sol ou le pH de notre sang. L’acide sulfurique, très corrosif, se situe au-dessous d’un pH 2,0. L’eau de mer se situe a un pH moyen de 8,0 et l’ammoniaque est alcalin avec un pH de 11,5. Dans les eaux soufrées du volcan Dallol situé en Ethiopie (photo d'introduction), le pH atteint même une valeur de −1,6 avec de l'acide sulfurique très concentré. Si l'échelle du pH va de 0 à 14, il existe quelques situations qui vont au-delà de ces limites.

Qu'est-ce qu'un ion H+ ?

Un poil de chimie s'impose. Sur le diagramme ci à gauche, pour l’eau (A), la molécule est H2O (C) soit un atome d’oxygène (D) et deux atomes d’hydrogène (E). L’atome d’oxygène possède 8 électrons (en vert) dont deux se situent sur le niveau extérieur. Comme les liaisons entre atomes sont assurées par les électrons, il ne peut y avoir que 2 atomes d’hydrogène liés à l’oxygène d’où le H2O. C’est ce que nous dit la physique moléculaire.
L’atome d’hydrogène ne comprend qu’un seul électron. C’est d’ailleurs le premier élément du tableau de Mendeleïev (tableau périodique) et le plus léger pour celles et ceux qui ont quelques souvenirs des cours de chimie. Son noyau ne contient qu’un seul proton et ne contient pas de neutron ce qui est particulier.

D’un point de vue électrique, il faut savoir qu’un électron est une charge négative. Donc, si un atome d’hydrogène perd son unique électron, il devient une charge positive et on l’appelle alors un ion H+. Ce ion H+ correspond aussi au proton puisqu’il n’y a pas de neutron dans le noyau.
C’est la mesure du nombre d’ions H+ dans une solution qui permet de déterminer la notion de pH.
Merci d'avoir pris le temps de lire cet article jusqu'à son terme, félicitations.




